Contaminación del agua
Ir al artículo
Ir al artículo
Ir al artículo
Gestión de aguas superficiales
Ir al artículo
LA CONTAMINACIÓN POR METALES
Miguel A. Blesa
Gerencia de Química, Comisión Nacional de Energía Atómica
Instituto de Investigación e Ingeniería Ambiental, Universidad Nacional de San Martín
Consejo Nacional de Investigaciones Científicas y Técnicas
Resumen
Los seres humanos han usado los metales desde los albores de las civilizaciones más primitivas. Muchas veces ello ha llevado a incorporar al agua de consumo humanos niveles inaceptables de metales. En este trabajo se describen los efectos toxicológicos de una serie de metales seleccionados: cromo (Cr), cobre (Cu), arsénico (As; el arsénico no es realmente un metal), cadmio (Cd), mercurio (Hg) y plomo (Pb). Describiremos brevemente el origen de la incorporación de cada elemento al agua, sus rutas metabólicas y sus efectos nocivos para la salud, mencionando en todos los casos los valores guía establecidos por la Organización Mundial de Salud como valores máximos aceptables de concentración en el agua de consumo humano.
Un poco de historia
Las aguas naturales contienen naturalmente metales disueltos, como iremos viendo en secciones posteriores. Pero, además, pueden incorporar metales provenientes de los materiales que usa el hombre. El uso de los metales está íntimamente asociado al desarrollo de la civilización. La organización social en ese amplio período correspondiente a la Prehistoria[1] estuvo asociada con el desarrollo de tecnologías para el uso de diversos materiales para fabricar armas, herramientas, utensilios.
Las Edades de Piedra[2] comprenden los primeros estadíos de la prehistoria: las edades Paleolítica, Mesolítica y Neolítica. Los nombres derivan de ?????, lithos, piedra en griego y de prefijos que indican viejo, medio y nuevo, respectivamente. En ellas, el hombre usaba la piedra, (sílex, cuarzo, cuarcita, obsidiana, etc.) para fabricar artefactos como los que se muestran en las Figuras 1 y 2. También se usó las arcillas de los sedimentos para hacer cerámicas.
La Figura 2 ilustra bien que las sociedades de las edades de piedra alcanzaron un apreciable grado de desarrollo cultural.
La transición entre las edades de piedra y la edad del bronce es la llamada Edad del Cobre. Hace más de 7.000 años, el hombre ya aprendió a usar el cobre; ello implicó el desarrollo de la minería de ese metal. El cobre existe en estado elemental en la naturaleza, y fue seguramente ese cobre el que primero se usó. Sin embargo, ya unos 5.000 años antes de Cristo se desarrollaron procesos extractivos de obtención cobre a partir de sus minerales, calcosita (Cu2S) y cuprita (Cu2O). El sulfuro era tostado al aire para obtener el óxido, y éste era reducido con carbón en presencia de aire, en un proceso antecesor al de los modernos altos hornos.

Figura 1. Artefactos de piedra característicos del paleolítico y del neolítico

Figura 2. Estructuras religiosas: el templo de ?gantija, Gozo, en el archipiélago de Malta (3500-2500 años antes de Cristo) y Stonehenge, Wiltshire, Reino Unido (alrededor de 2500 años antes de Cristo)
El uso temprano del cobre reconoce su origen en sus propiedades químicas. El metal es estable en contacto con agua. Para la semireacción (1),[3] E0 = + 0,34 V, lo que indica que el Cu0 es incapaz de liberar H2 del agua. Se puede corroer en atmósferas oxidantes, pero forma una capa protectora de óxido que inhibe el avance del ataque.
Cu2+ + 2 e- = Cu0 (1) En definitiva, se puede obtener con facilidad por reducción del óxido, y es estable en contacto con agua. Debe recordarse que el Cu pertenece al mismo grupo de la Tabla Periódica que plata y oro (grupo 11). Sólo el oro, que se encuentra en la naturaleza en estado elemental, fue usado por el hombre antes que el cobre.
Figura 3. (a) Punta de flecha y otras armas de la Edad de Cobre (3.200-2.300 años antes de Cristo). (b) Artefactos de la edad de bronce (2.300-950 años antes de Cristo). De la colección del Museo de Historia Natural y Arqueología de Vicenza (Italia). Ver: http://www.museicivicivicenza.it
Con la Edad de Bronce comienza el uso de aleaciones, y en particular una que puede llamar la atención en la actualidad: el llamado bronce arsenical, que no es otra cosa que cobre con una cantidad modesta (unos pocos por ciento) de arsénico. Probablemente esta aleación se obtuvo al procesar, para obtener cobre, sulfuros que contenían arsénico. Algunas de las propiedades mecánicas de la aleación impulsaron su uso.
El bronce es una aleación de cobre y otro elemento; el más usual es el estaño, y la composición más típica es Cu, 88%, Sn,12%. Los artefactos más antiguos de bronce datan de unos 4.000 años antes de Cristo. El bronce se obtiene mezclando los metales fundidos, y por lo tanto su desarrollo implicó el dominio de la metalurgia del estaño. También implicó la existencia de intercambio comercial entre regiones lejanas, ya que los minerales de cobre y de estaño no se presentan en regiones vecinas. La Figura 3 muestra algunos artefactos (armas) de las edades de cobre y de bronce.
La transición a la Edad de Hierro refleja claramente la compleja naturaleza de estas civilizaciones. En algunas regiones vecinas al Mar Mediterráneo, la transición fue relativamente brusca, con una disrupción violenta de la organización social. Las causas de esa disrupción son motivo de diversas hipótesis. El hierro tiene propiedades mecánicas (dureza) inferiores al bronce, pero la destrucción de las rutas de comercio hizo poco viable la producción de bronce. El hierro es más abundante, no necesita aleantes, y reemplazó en gran medida al bronce (ver Figura 4).

Figura 4. Artefactos de la Edad de Hierro. Por el deterioro (corrosión) típico de este emtal, muchos de los objetos recuperados de este período son de otros materiales, o contienen otros metales además de hierro. (a) espada de hierro; (b) navaja de afeitar de bronce; (c) puñal de hierro y plata. De la colección del Museo Arqueológico Nacional de España. Ver: http://ceres.mcu.es/pages/Main
Se acepta en general datar la finalización de la Edad de Hierro en la aparición de registros escritos. El desarrollo de la metalurgia de otros metales por supuesto continuó en forma activa. En la actualidad, el listado de elementos químicos usados por el hombre incluye prácticamente todos los de la Tabla Periódica. Desde el punto de vista del impacto ambiental, y en particular de la posibilidad de contaminación del agua, es importante tanto el volumen de producción y uso como las propiedades toxicológicas y ecotoxicológicas. Por ese motivo, centraremos lo que sigue en los siguientes elementos: cromo (Cr), cobre (Cu), arsénico (As; el arsénico no es realmente un metal), cadmio (Cd), mercurio (Hg) y plomo (Pb).
Es importante notar que se considera que los metales de transición que van del vanadio al cinc en la Tabla Periódica (V, Cr, Mn, Fe, Co, Ni, Cu, and Zn) y también el molibdeno y el tungsteno son esenciales para algunas formas de vida.[4]
Toxicología y ecotoxicología de metales en agua (casos seleccionados)
Cromo
El cromo se usa como aleante del hierro para formar los aceros inoxidables; en curtiembres, en las que se usa como cromato de potasio, K2CrO4; en galvanoplastia, para la obtención de recubrimientos (cromado), en forma de dicromato de potasio, K2Cr2O7; como pigmento (por ejemplo cromato de plomo, amarillo); y en la industria electrónica. Desde el punto de vista de la contaminación del agua, los dos usos críticos son el curtido de cueros y la galvanoplastia, a los que debe sumarse los aportes de rellenos sanitarios y de cementerios de automóviles. Cabe acotar que también debe tenerse en cuenta la inhalación, ya que el humo de cigarrillos y los gases de escape de motores de combustión externa lo contienen.[5]
El cromo en contacto con agua puede encontrarse en estados de oxidación +6 ó +3. Los estados de oxidación +2, +4 y +5 no tienen importancia (salvo tal vez como especies transientes, en la bioquímica del cromo).
Dependiendo del pH, el Cr(VI) en agua se encuentra como cromato, CrO42- o como dicromato, Cr2O72-:
2 CrO42- + 2 H+ = Cr2O72- + H2O (2)
En cambio, el Cr(III) dependiendo del pH se encuentra como Cr3+ (en medios extremadamente ácidos), o como alguno de sus especies de hidrólisis: Cr(OH)2+ o Cr(OH)+. La solubilidad del Cr(III) en agua es escasa, y en zona de pH de las aguas naturales, en ausencia de materia orgánica, se encuentra como partículas sólidas, Cr2O3.nH2O:
2 Cr3+ + (3+n) H2O = Cr2O3.nH2O: + 6 H+ (3)
Las cantidades relativas de Cr(III) y Cr(VI) en aguas naturales son muy variables. El potencial redox del par Cr(VI)/Cr(III) depende del pH, pero en todo el rango refleja el carácter oxidante del Cr(VI). A pH 0, el valor es E0 = + 1,23 V.
Cr2O72- + 14 H+ + 6 e- = 2 Cr3+ + 7 H2O (4)
Por el carácter oxidante del Cr(VI), la materia orgánica es capaz de reducirlo a Cr(III). Además, la misma materia orgánica es capaz de complejar al Cr(III), evitando que precipite y manteniéndolo disuelto.
Al ser el Cr(VI) más soluble que el Cr(III), su movilidad en medios acuosos es también mayor. En cambio, el Cr(III) se moviliza a través de sucesivos pasos de precipitación y redisolución (éste último, por la materia orgánica).
En aguas superficiales no afectadas por el hombre, los niveles usuales de cromo total rondan entre 0,5 y 2 ?g/L. Debido a los aportes de la actividad humana, los valore medidos pueden alcanzar los 10 ?g/L.[6] Es interesante notar los niveles medidos en agua de lluvia, que pueden alcanzar el valor de 1 ?g/L.
La principal fuente de ingesta humana de cromo son los alimentos, y puede llegar hasta valores de 1 mg/día. Los alimentos incorporan cromo a partir del acero inoxidable El agua aporta menos del 10/ de la ingesta total. Sólo una fracción menor de ese cromo es absorbido en los intestinos, 5% o menos. El Cr(VI) se absorbe más que el Cr(III), pero el mismo es parcialmente reducido a Cr(III) por los fluidos gastrointestinales. Se usa también en suplementos dietarios, como el picolinato de cromo; si bien esta sustancia parece no ser carcinogénica, tampoco hay ninguna seguridad sobre posibles efectos benéficos.
El Cr(VI) absorbido puede penetrar con facilidad las paredes celulares, y en el interior es reducido a Cr(III). Es por eso que el efecto toxicológico del Cr(VI) es más importante que el del Cr(III), si bien es finalmente este último el que ejerce efecto sobre las células, uniéndose al DNA y a otras macromoléculas biológicas. El Cr absorbido se elimina esencialmente por orina.
En muchos procariotas y eucariotas, el Cr(VI) produce mutaciones y efectos relacionados, como aberraciones en los cromosomas, mientras que el Cr(III) no es activo excepto, ta vez, a concentraciones muy elevadas. Se concluye entonces que el Cr(VI) (pero no el Cr(III)) es mutagénico para animales acuáticos.
El cromo es un elemento esencial para los mamíferos, para un metabolismo adecuado de azúcares, lípidos y proteínas, ya que potencia la acción de la insulina.[7] Sin embargo, los niveles requeridos son muy bajos, del orden de 0,5 a 2 mg de cromo absorbible, y es difícil que ocurran síndromes de deficiencia de cromo.[8]
En humanos, hay evidencia suficiente del carácter carcinogénico del Cr(VI) por inhalación (produce cáncer de pulmón por exposición ocupacional). La International Association for Research on Cancer (IARC) ha clasificado al Cr(VI) en el Grupo 1 (carcinogénico para el hombre) y al Cr(III) y Cr(0) en el Grupo 3 (no clasificable en su carácter carcinogénico para el hombre).[9]
A pesar de su carácter carcinogénico por inhalación, la OMS ha mantenido el valor guía provisorio de 0,05 mg/L para el cromo en agua, ya que entiende que este valor no presenta riesgos para la salud humana.
Cobre
Los artefactos de cobre expuestos al aire pueden desarrollar capas de óxido, o del bien conocido verdín, que es un carbonato básico. El uso de cobre para la cocción de alimentos ácidos puede conducir a la incorporación de sales solubles de cobre(II) al líquido, y en ciertos individuos la ingesta continuada puede conducir a una forma de cirrosis. Sin embargo, el uso de utensilios y cañerías de cobre es en general seguro.
En aguas dulces, los niveles naturales oscilan entre 0,20 y 30 mg/L. La minería del cobre puede producir incrementos muy grandes de los niveles de cobre en el agua: en áreas mineras se han medido valores de hasta 200.000 mg/L.[10] Los criterios de la Environmental Protection Agency (EPA) sobre niveles de cobre en aguas dulces para proteger la vida acuática indican que los niveles aceptables dependen de una serie de otros parámetros: temperatura, pH, carbono orgánico disuelto, calcio, magnesio, sodio, potasio, sulfato, cloruro y alcalinidad. Para establecer valores guía la EPA usa el Modelo de Ligando Biótico (en inglés, BLM), que tiene en cuenta que las especies agresivas son los iones Cu2+ y CuOH+. Los conceptos del BLM se muestran en la Figura 5.
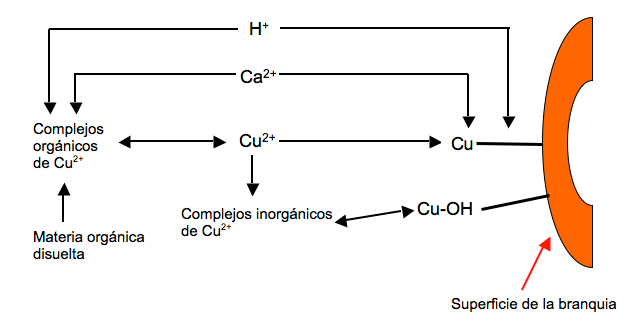
Figura 5. El modelo Cobre-Braquia y la especiación del cobre. Tomado de la referencia 3, y ésta de la referencia [11]
EPA propone como valores guía para la toxicidad aguda y la toxicidad crónica del cobre a animales acuáticos 4,67 y 1,45 ?g/L de Cu disuelto, respectivamente. El uso del BLM permite calcular los valores totales de cobre para cada caso específico.
Las aguas para consumo humano muestran valores que reflejan la incorporación desde las cañerías. Es así que, en un estudio en varios países centrales, los valores del agua de red, después de un tiempo de flujo, varió entre ?0,005 y >30 mg/L. Los valores medidos suelen ser apreciablemente mayores al abrir el grifo y tomar agua que estuvo estancada en las cañerías.[12]
En los países centrales, la ingesta de cobre en los adultos oscila entre 1 y 5 mg/día, con contribuciones del agua, de los alimentos y de suplementos dietarios. El agua aporta entre 0,1 y 1 mg/día (ver referencia 5). Dado que el cobre se acumula en el agua estancada en las cañerías, para los niños se recomienda muy especialmente dejar correr agua antes de uso.
La dosis letal para humanos varía entre 4 y 400 mg Cu/kg de peso corporal. Se han hecho muchos estudios del efecto de dosis más bajas (en particular en Chile, país con extensa minería de cobre), lo que ha permitido a la Organización Mundial de la Salud (OMS, o WHO en inglés), establecer un valor guía de 2 mg/L para el agua de consumo humano, suponiendo un consumo diario de 2 L.
Arsénico
Introducción
Por la importancia de la contaminación de aguas por arsénico, que reconoce como origen tanto factores naturales como la acción antrópica, esta Sección es más larga que las anteriores.
Más que un metal, el arsénico es un metaloide. Como ya se mencionó, se usó desde la Prehistoria como aleante de cobre; aun hoy se usan algunas aleaciones que contienen arsénico. Por su toxicidad aguda, se han ido abandonando otros usos del arsénico; por ejemplo, como pigmento, en forma de oropimente (As2S3) y de rejalgar (AsS). Aun en la actualidad se usa como preservante de maderas contra hongos e insectos; el producto, conocido como arseniato cromado de cobre (en ingles, la sigla es CCA) es una mezcla de óxidos y sales de cobre, cromo y arsénico. Este producto enfrenta serias restricciones en EE.UU. y Europa por su riesgo toxicológico (en particular, por la inhalación en caso de incendios en ambientes cerrados).
Cuadro I
El arsénico como veneno en la historia
El trióxido de arsénico es un poderoso veneno, y se supone que se usó mucho como tal en todo tipo de intrigas palaciegas en la Edad Media y épocas posteriores. Analicemos dos casos muy conocidos: Lucrecia Borgia y Napoleón Bonaparte.
Napoleón: A partir de la descripción de los síntomas provista por las memorias de su valet en la reclusión en la isla de Santa Helena, S. Forshufvud propuso que Napoleón había muerto por envenenamiento por arsénico. El análisis del cabello demostró efectivamente la presencia de arsénico. Sin embargo, en la actualidad se cree que el origen del envenenamiento fueron vapores arsenicales desprendidos de los pigmentos verdes del empapelado de la habitación de Napoleón. (Ver: H. Ball, Arsenic poisoning and Napoleon’s death, The Victorian Web, http://www...org/history/arsenic.html.
Lucrecia Borgia: Víctor Hugo (y después muchos otros, como Alejandro Dumas) describen a los Borgia como envenenadores (envenenadores seriales, diríamos ahora). Se les atribuye usar como veneno la cantarella, que se obtenía de la masa putrefacta y licuada de un cerdo colgado boca abajo y apaleado hasta morir, más las entrañas de un sapo sazonadas con arsénico. Por supuesto, todas estas historias carecen totalmente de basamento histórico. Relacionado con este tema, un divertido artículo del cineasta argentino Miguel Krebs atribuye a Leonardo da Vinci un fallido intento de desarrollar un veneno para Cesar Borgia (http://www...rmets/venenos/borgia.htm)
[The poison of the Borgias, say contemporary writers, was of two kinds, powder and liquid. The poison in the form of powder was a sort of white flour, almost impalpable, with the taste of sugar, and called Contarella. Its composition is unknown. The liquid poison was prepared, we are told in so strange a fashion that we cannot pass it by in silence. We repeat here what we read, and vouch for nothing ourselves, lest science should give us the lie. A strong dose of arsenic was administered to a boar; as soon as the poison began to take effect, he was hung up by his heels; convulsions supervened, and a froth deadly and abundant ran out from his jaws; it was this froth, collected into a silver vessel and transferred into a bottle hermetically sealed, that made the liquid poison.]
A. Dumas, The Borgias, Celebrated Crimes, http://www.gutenberg.org/files/2741/2741.txt

Póster de la película Los Borgia (Antonio Hernández, 2006)
Otro ejemplo más reciente: En 1944, Frank Capra dirige la película Arsénico y encaje antiguo. Sobre el argumento de esta película, dice Wikipedia:
Mortimer encuentra un cadáver escondido en un arcón debajo de la ventana y sospecha de Teddy, pero sus tías le explican que son ellas las responsables. Ellas han desarrollado el “mal hábito” de acabar con la vida de hombres solteros que sufren de soledad. Les dan a beber vino de bayas mezclado con arsénico, estricnina y “una pizca de cianuro”. Los cuerpos son enterrados por Teddy en el sótano, que cree que está cavando agujeros para el Canal de Panamá y enterrando víctimas de la fiebre amarilla. Ver:http://es....iki/Arsenic_and_Old_Lace

Imágenes de Arsénico y encaje antiguo (Capra, 1944)
El arsénico en aguas naturales. El Hidroarsenicismo Regional Crónico Endémico (HACRE)
Las aguas naturales pueden poseer elevados tenores de arsénico, aun sin la intervención del hombre. El agua de mar contiene del orden de 1,5 ?g/L, y las aguas dulces superficiales habitualmente menos de 1 ?g/L. Sin embargo, en cuencas endorreicas como las del río San Antonio de los Cobres, en Salta, afectadas por manifestaciones geotermales, pueden encontrarse valores mucho más elevados (superiores a 50 ?g/L). De la misma manera, las aguas superficiales de la II Región de Chile (Antofagasta, Calama, Tocopilla, Mejillones) tienen contenidos de arsénico de hasta 800 ?g/L.13 Las aguas subterráneas pueden tener tenores muy elevados; dependiendo de la geología del lugar, los niveles pueden ser tan bajos como 0,5 ?g/L o llegar a valores como los medidos en Campo de Géiseres El Tatio en el norte chileno, que llegan a cifras tan extremas como 30.000 ?g/L.14
El arsénico puede ser ingerido bebiendo agua contaminada, o alimentos ricos en este elemento. En particular, los pescados y mariscos pueden contener hasta 100 mg/kg. En este caso, se trata en general de compuestos orgánicos de arsénico de baja toxicidad, como la arsenobetaína, (CH3)3As+-CH2-CO2-.
El arsénico de las aguas naturales es arsénico inorgánico. Dependiendo de las condiciones de oxigenación de las aguas, se puede encontrar como aniones derivados del ácido arsénico (estado de oxidación 5+, As(V))o del ácido arsenioso (estado de oxidación 3+, As(III)). En las condiciones usuales de pH, los arseniatos se encuentran esencialmente como HAsO42- y los arsenitos como H3AsO3. El arsénico inorgánico es más tóxico que el orgánico que se encuentra en los alimentos, y como arsenito es más tóxico que como arseniato. Algunos compuestos orgánicos sencillos (que no se encuentran en los alimentos), como la arsina, AsH3, la monometilarsina, (CH3)AsH2 y la dimetilarsina, (CH3)2As son más tóxicos que el As(V). La dosis letal para humanos del As2O3 es del orden de 1,5 mg/kg de peso.
Si bien se ha informado algún caso de intoxicación aguda por ingesta de aguas de pozo con muy alto tenor de arsénico, el problema sanitario más serio se refiere a la ingesta crónica de aguas con niveles intermedios de este elemento. En nuestro país este síndrome se conoce como Hidroarsenicismo Crónico Regional Endémico (HACRE), y fue descrito por primera vez en la localidad cordobesa de Bell Ville en 1913, por el médico Mario Goyenechea quien combinó los resultados de los análisis químicos de Agustín Pusso con sus propias observaciones clínicas.15 La descripción detallada de síntomas la hizo Ayersa en 1917.16
La OMS reconoce como síntomas de la intoxicación crónica con arsénico lesiones de la piel como hiper- e hipopigmentación, neuropatía periférica, cáncer de piel, cáncer de vejiga y de pulmón, enfermedad vascular periférica.17 Las lesiones de la piel son los síntomas más usuales, y requieren de varios años de consumo para su manifestación. La Figura 6 muestra dos ejemplos.
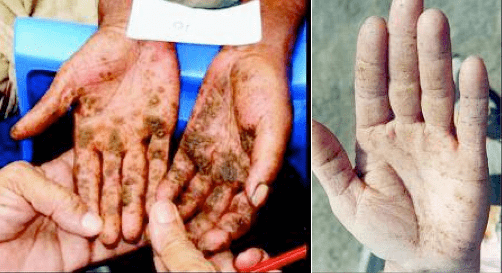
Figura 6. Queratosis arsenical. La foto de la izquierda es un caso de la India, tomado de la referencia18. La foto de la derecha es un caso en Santiago del Estero, tomado de la página del médico rural Carlos Alberto Padial, http://www.hidroarsenicismo.com.ar
Los niveles altos de arsénico en agua afectan muchas regiones del mundo, como puede verse en la Figura 7. Taiwan, Bengala del Oeste (en India) y Bangla Desh, por la densidad de población y por los niveles medidos de As son las regiones más afectadas.
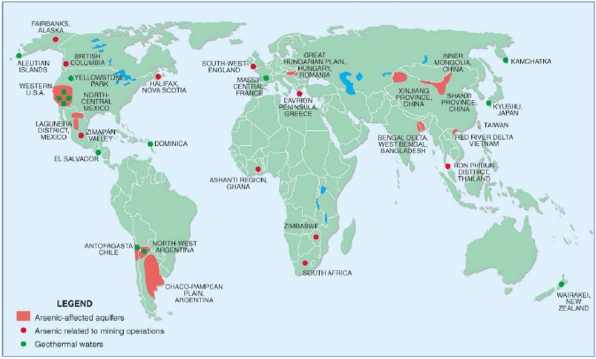
Figura 7. Mapa del arsénico en agua. Tomado de la referencia [19]
Con el auspicio conjunto del Programa Ambiental de las Naciones Unidas (en inglés, UNEP), la Organización Internacional del Trabajo (OIT) y la Organización Mundial de la Salud, el International Programme on Chemical Safety (IPCS) produjo en 2001 un exhaustivo informe sobre los efectos toxicológicos del arsénico.[20]
Sobre esta base, la OMS analizó los criterios para escoger valores guía para arsénico en agua (referencia 15). Sus conclusiones establecen que no se conocen bien los mecanismos de acción del As, aunque queda establecido que existe una relación causal entre la exposición prolongada al arsénico en el agua de consumo humano y un aumento en el riesgo de contraer cáncer de piel, vejiga, pulmón y riñón y de otras afecciones de la piel como hiperqueratosis y cambios en la pigmentación. La falta de información precisa sobre la posible incidencia de niveles moderados, lleva a la OMS a basar sus recomendaciones en un criterio precautorio sumado a las posibilidades reales de las tecnologías para abatir el arsénico. Se concluye que:
En vista de las incertezas significativas que rodean la evaluación del riesgo para la carcinogenicidad por arsénico, y las dificultades prácticas para remover el arsénico del agua de consumo humano, se conserva el valor guía de 10 mg/L. En vista de las incertezas científicas, se designa este valor guía como provisorio. En muchos países, puede no ser posible alcanzar este valor guía; cuando sea éste el caso, deben realizarse todos los esfuerzos posibles para mantener las concentraciones tan bajas como sea posible.[21]
Gestión de aguas arsenicales. Abatimiento del arsénico.
La gestión del hidroarsenicismo en Argentina refleja claramente las dificultades originadas tanto en el comportamiento de los sistemas naturales como en los factores sociales.
En la Argentina, la cantidad de personas potencialmente afectadas por los niveles de arsénico en las fuentes de agua de consumo es muy grande. Se ha estimado que el 5% de la población puede sufrir este problema (del orden de 2.000.000 de personas expuestas a niveles intermedios).[22] En efecto, en grandes extensiones del territorio nacional las aguas subterráneas contienen niveles relativamente elevados de arsénico. Los hidrogeólogos han caracterizado y analizado la seriedad del problema en la llanura chaco-pampeana, en la provincia geológica de la Puna, en Cuyo, y, con menor cantidad de información, en la Patagonia.[23] Por la cantidad de habitantes, el impacto del arsénico en la llanura chaco-pampeana es el que ha concitado más atención. Es especial, la toma de conciencia de que el problema también afecta a la provincia de Buenos Aires es sólo reciente.
El Código Alimentario Argentino (CAA) en su Artículo 982 (Res Conj. SPRyRS y SAGPyA N° 68/2007 y N° 196/2007)[24] establece como valor máximo de la concentración de arsénico en el agua potable el valor de 0,010 mg/L (10 mg/L).[25] Sin embargo, en línea con lo establecido por la OMS aclara que:
La autoridad sanitaria competente podrá admitir valores distintos si la composición normal del agua de la zona y la imposibilidad de aplicar tecnologías de corrección lo hicieran necesario.
Para aquellas regiones del país con suelos de alto contenido de arsénico, se establece un plazo de hasta 5 años para adecuarse al valor de 0,01 mg/L.
En consecuencia, en la práctica sigue vigente el límite de 0,05 mg/L.
El cambio del valor límite reconoce su origen en el principio precautorio, en vista de las incertidumbres en los efectos toxicológicos a largo plazo. El nuevo límite, como lo establece la OMS, reconoce más el estado del arte en las tecnologías de abatimiento de arsénico en los países centrales, y las dificultades en la determinación de esos niveles de arsénico, que la evaluación precisa de la toxicidad en esos niveles. Se acepta que es muy difícil demostrar la incidencia epidemiológica del arsénico en esos niveles.
Cuadro II
La gestión del agua y la lección de Bangla Desh
En la década de 1970, UNICEF recomendó en Bangla Desh la instalación de tubos provistos de bombas manuales para la extracción de agua desde acuíferos ubicados a unos 200 m de profundidad. Se buscaba así resolver el serio problema sanitario causado por la contaminación microbiológica de las aguas superficiales. No se advirtió que los niveles de arsénico de las aguas profundas eran muy elevados; se comprobó más adelante, en 1998, que el 35% de los tubos tenían niveles de arsénico superiores a 50 mg/L, y que el 8,4% contenía arsénico por encima de 300 mg/L. Las primeras evidencias firmes de lesiones cutáneas en pobladores de Bangla Desh expuestos al arsénico se obtuvieron en 1987.
La magnitud del problema, en función de los muy altos niveles de arsénico y de la cantidad de personas potencialmente expuestas llevó a la OMS a caracterizar al mismo como el envenenamiento masivo más grande de la historia de la humanidad. La población expuesta se estima entre 35 y 77 millones de personas. (A.H. Smith, E.O. Lingas y M. Rahman, Contamination of drinking-water by arsenic in Bangladesh: a public health emergency, Bulletin of the World Health Organization 78 (9), 1093-1103 (2000)).
Las respuestas ante esta emergencia debieron tener en cuenta la realidad socioeconómica. Una batería de acciones permite una mejor solución que drásticas soluciones únicas. En primer lugar, la promoción de técnicas de desinfección de aguas superficiales, libres de arsénicos pueden proveer una respuesta parcial, aunque puede haber resistencia a la adopción de esta solución. La provisión de filtros hogareños sencillos también es una buena contribución. Muy importante, los niveles de arsénico varían mucho de un pozo a otro, y un relevamiento adecuado permite identificar pozos aptos y pozos que deben clausurarse. La Figura muestra una unidad de filtración provista por UNICEF.

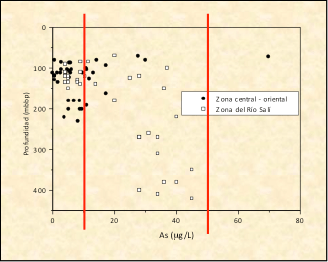
Figura 8. Concentraciones de arsénico en pozos de la provincia de Tucumán. Tomado de la referencia [26]
Todos los pozos ubicados entre las líneas rojas proveen aguas que son aptas según el nivel de 50 mg/L, pero no según el nivel de 10 mg/L.
Esta situación se repite en grandes regiones del territorio nacional, incluyendo la llanura chaco-pampeana y, dentro de ella, las provincias de Buenos Aires, Córdoba y Santa Fe. Será pues necesario disponer de plantas de abatimiento de arsénico en gran cantidad de localidades.
Veamos cuáles son las posibles tecnologías para el abatimiento de arsénico. La experta chilena Ana María Sancha nos provee un listado;[27] con algunas modificaciones, la Tabla 1 muestra el mismo.

Tabla I. Tecnologías para el abatimiento del arsénico en agua
El estado de desarrollo de las tecnologías emergentes es muy variado; salvo alguna excepción, no hay experiencia operativa en campo. A continuación haremos una breve descripción de la experiencia operativa argentina con algunas de estas tecnologías.
La ósmosis inversa hace pasar el agua de alimentación tangencialmente a una membrana semipermeable que no deja pasar ninguna sustancia disuelta, incluyendo el arsénico. El agua que atraviesa la membrana, forzada por una presión elevada, queda pues purificada. La técnica es muy poderosa, pero tiene limitaciones muy importantes. En primer lugar, el volumen del agua de rechazo (concentrado en la Figura 8) es muy grande, el proceso es ineficaz para aguas de alta salinidad, y las membranas pueden deteriorarse por depósitos, y por biofouling. El sistema requiere de elevadas presiones, típicamente entre 10 y 20 bars,[28] y este requerimiento implica un consumo energético importante.
La provincia de La Pampa instaló a partir del año 1978 varios sistemas de abatimiento de arsénico en agua potable mediante ósmosis inversa (en La Humada, Algarrobo del Águila, Limay Mahuida, Mauricio Mayer y Metileo). Las dos últimas tienen red con medición de consumo en la conexión domiciliaria y las tres primeras localidades tienen red de agua sin tratar y canilla pública para agua tratada. El concentrado que queda como residuo se vuelca a una laguna existente (Lastiri et al 1984). En Selva (Santiago del Estero) se instaló en 1980 una planta por ósmosis inversa para tratar agua de un pozo de 40 m de profundidad; la planta alimenta una pequeña red de distribución con 8 canillas públicas y 4 domiciliarias.[29] La (hospital, iglesia, delegación municipal y planta de tratamiento) Tanto el intercambio de iones como la ósmosis inversa, demuestran un rendimiento pobre en presencia de concentraciones de sulfatos superiores a 25 mg/L, como ocurre con las aguas de Huinca Renanco, Córdoba.[30] Está pendiente una evaluación global de la experiencia operativa con plantas de ósmosis inversa en la Argentina.

Figura 8. A la izquierda, un esquema del proceso de ósmosis inversa. A la derecha, foto de un equipo comercial
La adsorción con hidróxido férrico granular (GFH) se ofrece para abatir arsénico en grifos domiciliarios (2 L/minuto), para pequeñas empresas (hasta 2 m3/hora) y para redes de distribución (del orden de 1000 m3/día).[31] El adsorbente es una mezcla de hidróxido férrico y una variedad del oxohidróxido de hierro, la akaganeíta, ?-FeOOH. Este material tiene alta capacidad de adsorción; lógicamente requiere de procedimientos de disposición de los filtros saturados, o de los líquidos de regeneración. Quien escribe esto no dispone de información sobre la experiencia operativa de esta tecnología en Argentina.
Las plantas más importantes usan la remoción por adsorción. Existen varias alternativas, como se muestra en la Tabla I. El adsorbente más eficiente se basa en óxidos de hierro, ya que éstos poseen una afinidad especialmente alta por el As(V). Un requisito imprescindible, general para todas las tecnologías pero especialmente importantes en aquellas que se basan en la adsorción, es que el arsénico esté oxidado, ya que la adsorción del As(III) es más débil. Por ese motivo las plantas suelen combinar una etapa de oxidación (que es también de desinfección). Una de las plantas más importantes se encuentra en la localidad de Carlos Casares, en la Provincia de Buenos Aires. Desde que entrara en operación, la planta pudo diminuir los niveles de arsénico a la mitad, pero aun así no pudo llegar al límite de 50 ?g/L. En la actualidad (septiembre de 2010), se está completando la instalación de un decantador que permita alcanzar valores por debajo de ese límite (ver Figura 9).
En vista de la tendencia a bajar el límite aun más, se vuelve muy importante la realización de una evaluación de las posibilidades reales de las plantas instaladas en lograr dichos valores. Debe tenerse en cuenta que la eficiencia depende fuertemente de la composición de las aguas, y los resultados de otras regiones no son extrapolables a otras localidades.

Figura 9. Decantadores de la planta de abatimiento de arsénico de Carlos Casares (Provincia de Buenos Aires).[32]
En la Argentina, los desarrollos realizados por el Centro de Ingeniería Sanitaria de la Facultad de Ingeniería de la Universidad Nacional de Rosario son importantes. Las plantas desarrolladas usan un coagulante de cloruro de polialuminio, que permite alcanzar valores por debajo del límite de 50 µg/L. Una planta de este tipo opera en Villa Cañás (una población de Santa Fe) desde 2001.[33]
Es también interesante mencionar un desarrollo reciente de la Universidad Nacional de La Plata, que usa arcillas naturales de la zona de Tandil para remover muy eficientemente el arsénico. Esas arcillas contienen altos niveles de hierro, que aparentemente favorece la remoción. Ya se ha hecho una prueba de campo en Punta Indio.
La Provincia de Buenos Aires, por convenio entre la Comisión de Investigaciones de la Provincia de Buenos Aires y el Ministerio de Infraestructura está montando un laboratorio de referencia en el Instituto de Hidrología de Llanuras (IHLLA), de la Universidad Nacional del Centro, en Azul, para medir con exactitud los niveles de arsénico y validar las diversas tecnologías propuestas para su abatimiento.
CadmioEl cadmio en la naturaleza se encuentra asociado al cinc, con el que comparte muchas propiedades químicas. La incorporación natural de cadmio a las aguas puede ocurrir entonces por disolución de minerales de cinc. Los niveles que se alcanzan así son bajos, inferiores a 1 µg/L.[34] También se puede incorporar al agua corriente por corrosión de las cañerías que contienen cinc. En estos casos los niveles pueden aumentar, hasta varias decenas de microgramos por litro. Sin embargo, la principal ingesta de cadmio en seres humanos proviene de los alimentos. Se estima una ingesta diaria del orden de 10-35 µg/L, de los cuales sólo 2 µg/L provienen del agua.
La toxicidad del cadmio para los seres humanos está bien documentada. Se estima que la dosis letal está entre 350 y 3500 mg. Los efectos crónicos están también muy bien documentados, a raíz del caso de envenenamiento por cadmio registrado en la Prefectura de Toyama, en Japón. La explotación de las minas de Kamioka, por la Mitsui Mining and Smelting Co. produjo la liberación de altos niveles de cadmio a las aguas del río Jinzu. Los orígenes de la contaminación se remontan a 1912 (contemporáneo con el registro del hidroarsenicismo en Bell Ville), pero los casos se registraron muchos años más tarde, espeiclamente en la década de 1940. La etiología por cadmio se sospechó recién en 1955, muchos años después que las medidas preventivas evitaran la aparición de nuevos casos. La enfermedad, conocida localmente como itai-itai, atacó principalmente a mujeres maduras, en quienes producía fallas renales y ablandamiento óseo, con fuertes dolores. La excreta de cadmio es extremadamente lenta, del orden de 0,005% de la ingesta. La acumulación genera los daños señalados debidos a las similitudes químicas entre cadmio y calcio. Aparentemente, el factor fundamental es el daño de las mitocondrias de las células renales.
La fuente principal de ingesta, más que la propia agua, fueron los cultivos de arroz irrigados con aguas del río Jinzu.
Sobre la base de suponer que el 10% de la carga total se debe a la ingesta de agua, la OMS ha establecido el valor guía provisorio de 3 µg/L en el agua de consumo humano.
MercurioEl mercurio se usa en uno de los procesos clásicos de obtención de soda cáustica y cloro, el proceso Castner-Kellner, que se basa en la electrólisis de soluciones acuosas de cloruro de sodio, usando un cátodo de mercurio.[35] También se usa en termómetros, lámparas, amalgamas dentales. Sus compuestos se usan en fungicidas, antisépticos y otras aplicaciones. Las fuentes antrópicas de mercurio son, fundamentalmente, el proceso Castner-Kellner,[36] la combustión de carbón (donde está presente como impureza), la incineración de residuos y el procesamiento de metales (el mercurio se usa para amalgamar metales; en la actualidad, la extracción de oro amalgamándolo ha sido reemplazada por la extracción con cianuro). Las fuentes naturales son las cenizas volcánicas, la liberación desde depósitos naturales, y la volatilización desde el mar. En todos los casos la atmósfera actúa como una gran cinta transportadora, que produce depósitos en los cuerpos de agua. En estos cuerpos entra fundamentalmente como compuestos inorgánicos de Hg(II), y sus niveles son habitualmente muy bajos, 0,5 µg/L o menos. Se ha estimado que las fuentes antrópicas han, por lo menos, duplicado los niveles de mercurio atmosférico.
Aun cuando los niveles de mercurio en las aguas son extremadamente bajos (excepto en ocasiones de contaminación como la de la Bahía de Minamata, en Japón, que se describe más abajo), en la última década del siglo pasado comenzó a advertirse que el consumo de pescado puede conducir a niveles de ingesta de mercurio desaconsejables. En EE.UU., la mayoría de los estados emitió alertas sobre consumo de pescado, por sus niveles de mercurio. En ese contexto, la duplicación de los niveles atmosféricos es preocupante, ya que es éste el mercurio que se concentra en los peces.
El mercurio que entra en las aguas sufre una serie de transformaciones muy complejas, y difícil de caracterizar con certeza por los bajos niveles que deben medirse. Los compuestos de Hg(II) que entran a las aguas pueden reducirse, pueden asociarse al material particulado y sedimentar, y pueden, por acción de bacterias (Pseudomonas spp. y bacterias anaeróbicas que contienen la enzima metano-sintetasa), transformarse en metilmercurio nombre con el cual se suele englobar al catión metil mercurio, Hg(CH3)+, al dimetlmercurio Hg(CH3)2 y a otros homólogos superiores como el etilmercurio. El metilmercurio puede ingresar fácilmente en la cadena trófica, y acumularse por su lenta eliminación. El mercurio de los peces está precisamente en forma de compuestos orgánicos, de los cuales el metilmercurio es el más sencillo. El factor de acumulación, definido como la relación entre la concentración de mercurio en el tejido del pez y la concentración en el agua, puede alcanzar valores de hasta 100.000.[37]
En humanos, la ingesta de mercurio inorgánico (sales de Hg(II)) produce falla renal, mientras que la ingesta de mercurio orgánico (metil- y etil-mercurio) produce daño neurológico. Si bien se han informado casos de envenenamiento agudo por mercurio inorgánico, la mayor preocupación surge de los efectos de consumir alimentos contaminados. Se registró un caso muy grave de intoxicación con pan preparado con harina contaminada con fungicidas que contenían metilmercurio. Este hecho ocurrió en Iraq, a principios de la década de 1970, y resultó en 500 muertes.[38] También hay registros de casos puntuales de intoxicación con fungicidas en otros países (ver referencia 34).
La fuente más importante es el consumo de pescado. El consumo de 200 g de pescado que contiene 500 µg/kg conduce a la ingesta de 100 µg de metilmercurio, lo que representa el 50% del valor límite provisional recomendado para la ingesta semanal; como referencia, se han medido niveles de hasta 1200 µg/kg en el atún del mar Mediterráneo (ver referencia 36).
Los mecanismos por los cuales el metilmercurio genera daño neurológico en los adultos no se conoce bien, pero en sus primeras etapas el efecto principal es la inhibición de síntesis de proteínas. Los efectos de la exposición prenatal son mucho más severos y generalizados. Se afecta el desarrollo neuronal, produciendo una arquitectura cerebral alterada, células heterotópicas y masa cerebral menor. También se afecta la división celular en las etapas críticas de formación del sistema nervioso central.
Cuadro III
La enfermedad de Minamata
La enfermedad de Minamata es una encefalopatía y neuropatía periférica causada por la ingesta diaria de pescados y mariscos contaminados con metilmercurio. Los peces, camarones, cangrejos y mariscos en general incorporan el metilmercurio a través de las agallas y del tracto gastrointestinal. El brote de la enfermedad de Minamata ocurrió en el ára costera del mar de Yatsushiro, especialmente en la bahía de Minamata en la Prefectura de Kumamondo. Otro brote ocurrió después en la Prefectura de Niigata.
Durante muchos años, la planta de producción de acetaldehído de la compañía Chisso descargó al mar sus efluentes, los que contenían metilmercurio (usado como catalizador del proceso). La Figura muestra un esquema de la planta, tomado de los Minamata Disease Archives (http://www...hives/english/index.html). La descarga comenzó en la década de 1930, pero los efectos clínicos fueron observados mucho más tarde, a partir de 1956 y recién en 1959 pudo establecerse una relación causal con los niveles de mercurio en el agua de la bahía.
Como ocurrió con la industria del tabaco, los resultados de los estudios conducidos por la propia compañía fueron ocultados y abortados.
El brote de la prefectura de Niigata ocurrió hacia 1965, y tuvo su origen en efluentes de otra planta similar a la de Chisso.
Hasta 2001, se reportaron oficialmente 2.265 víctimas, con 1.784 muertes.[39] Hacia 2006, se reconocía del orden de 3.700 personas afectadas, en condiciones de entablar juicio.[40]

La OMS ha establecido como valor guía provisorio, la cantidad de 0,001 mg/L (1 µg/L) (cifra redondeada), sobre la base de suponer que la ingesta por agua es aproximadamente un 10% de la ingesta total.
Los ríos urbanos altamente contaminados, como el Riachuelo o el Reconquista en el área Metropolitana Buenos Aires, serán analizados en otra entrega. Cabe señalar aquí sin embargo que los contenidos de metales en los sedimentos marcan un registro de la evolución histórica de la contaminación, ya que los sedimentos más profundos son más antiguos. La Figura 10 muestra los contenidos de plomo, cromo y mercurio medidos en sedimentos de distinta profundidad del Riachuelo.[41] Las mediciones constituyen un registro que barre desde aproximadamente 1940 hasta 1993. Puede advertirse que para esta última fecha los niveles de cromo y de plomo estaban disminuyendo en los sedimentos, lo que indica una descarga menor de estos metales al curso de agua. En cambio, los niveles de mercurio siguieron aumentando hasta esa fecha. No se dispone de datos más recientes. Es importante también notar que los niveles detectados exceden largamente los valores guía de calidad de sedimentos marinos (en inglés, SGQ), ya sea el valor llamado de rango de efectos bajo (en inglés, ERL) o el valor de rango de efectos medio (en inglés, ERM) que describen respectivamente, el valor límite por debajo del cual es poco probable observar efectos en la biota, y el valor límite por encima del cual es muy probable observar efectos en la biota. Par el mercurio, se ha informado ERL: 0,15 mg/kg y ERM: 0,75 mg/kg.[42]
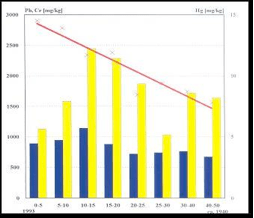
Figura 10. Niveles de plomo, cromo y mercurio en sedimentos del Riachuelo. Tomado de la referencia 41.Plomo: barras azules. Cromo: barras amarillas. Mercurio: cruces rojas. Adviértase que la escala para mercurio (a la derecha) es diferente.
Cuadro IV
Una anécdota personal
La sensibilidad de la población para los temas de contaminación ha aumentado notablemente en los últimos años, respondiendo en parte al conocimiento más detallado que se tiene sobre los efectos de la contaminación. Las posibilidades de la Química Analítica han ido también en aumento, pero la lectura no informada de los resultados del análisis químico conduce a veces a reacciones exageradas.
Hace unos años, la Unidad de Actividad Química de la Comisión de Energía Atómica recibió una consulta sobre la posible contaminación del agua en la ciudad de Concepción, en Tucumán, por rotura del mineraloducto de Minera La Alumbrera. Se tomaron muestras de agua y se analizaron; en una de las muestras, procedente de la plaza central de la ciudad, se midió 2,2 µg/L de mercurio. Como se indicó en este texto, el valor guía es 1 µg/L, con lo que claramente esa muestra estaba fuera de los límites de calidad. Me tocó participar en una audiencia pública, en la que afloró de inmediato el descreimiento de los pobladores para con las autoridades. Intenté explicar que ese nivel de mercurio requería que se estudiara el origen del problema y que se resolviera el mismo, pero que no era un resultado extremadamente alarmante (el valor guía, reconocido por la propia OMS, surge de un redondeo y de una serie de estimaciones en las que se aplica el principio de precaución). La respuesta fue destemplada y resultó difícil restaurar el diálogo. Finalmente se convino un programa de monitoreo, y en las nuevas mediciones se comprobó que el problema no se repitió. Nuestra interpretación es que ese mercurio provenía del uso de cloro para desinfectar el agua, cloro que debía haber sido obtenido por el proceso de Castner-Kellner. Al reemplazar la fuente de cloro el problema queda solucionado. Hay varias lecciones interesantes, que se contraponen entre sí:
1. Sin la efervescente participación popular, el problema probablemente no habría sido detectado, y la contaminación hubiera continuado.
2. Existe un fuerte cuestionamiento a la actividad minera, que muchas veces no se condice con la evidencia real, y que se basa muy especialmente en las historias de prácticas pasadas, que no son patrimonio exclusivo de esa actividad.
3. La participación popular a veces se ve empañada por el uso excesivo de la pasión en desmedro de la razón.
4. Sigue habiendo credibilidad de los laboratorios de ciencia y técnica, mientras que la credibilidad de los funcionarios responsables de la gestión ambiental es en general baja.
Plomo
En el pasado, la principal fuente de ingreso del plomo al hombre eran las emisiones de los automóviles cuando se agregaba plomotetraetilo a la nafta como antidetonante. Con el reemplazo de este combustible por formulaciones libres de plomo, la ingesta por agua se volvió más importante; sin embargo, esta ingesta sigue representando no más del 20% de la ingesta total.42 La OMS recomienda como valor guía 0,010 mg/L (10 ?g/L),43 dado que ese valor se estima conservadoramente para protección de infantes. El Código Alimentario Argentino, a su vez, establece el límite de 0,050 mg/L (50 ?g/L).44 Cabe destacar que la OMS advierte que su límite no se puede alcanzar si la red de agua contiene cañerías de plomo, o con soldaduras de plomo, como es muy frecuente en Argentina.
El plomo ingerido es transportado principalmente asociado a la hemoglobina, y en el corto plazo se deposita en los tejidos blandos (sangre, hígado, pulmones, bazo y médula ósea. En estos órganos su tiempo de residencia es bajo (1-2 meses), y se elimina principalmente por vía renal. Sin embargo, la ingesta prolongada conduce a la acumulación en huesos, en los que puede permanecer muchos años.
El plomo es un veneno acumulativo; la población más susceptible a efectos adversos lo constituyen las embarazadas, los fetos y los niños. Los efectos tóxicos más importantes se manifiestan en los sistemas nerviosos central y periférico. Estos efectos se manifiestan asociados a concentraciones en sangre tan bajas como 15 ?g/dL. Por encima de 40 ?g/dL se manifiestan otros efectos claros como anemia, disfunción de gónadas, etc.
CONCLUSIONES
Los niveles guía, que establecen cuáles son las concentraciones máximas aceptables para el agua de consumo humano, se fijan por un procedimiento que tiene en cuenta el estado del conocimiento sobre la toxicología de cada metal. Los posibles efectos a largo plazo de pequeñas concentraciones son más difíciles de establecer con certeza, y ello lleva a establecer límites usando un criterio precautorio. Estos límites están también afectados por la disponibilidad de tecnologías para la medición del contaminante en el agua, y para su remoción. La mayoría de los elementos descritos en este trabajo se incorporan al agua por la acción del hombre (origen antrópico); la excepción más importante es el arsénico que, en la Argentina y en otras regiones del mundo, proviene de la incorporación del elemento desde los sedimentos, sin intervención del hombre.
GLOSARIO
Adsorción: proceso de fijación en la superficie de un sólido de una especie química originalmente disuelta.
Biofouling (traducción literal: ensuciamiento biológico): formación de depósitos, esencialmente microbiológicos, sobre una superficie inmersa en agua. Estos depósitos forman una película orgánica compuesta por microorganismos en una matriz polimérica creada por ellos mismos (biopelícula).
Branquia: órgano respiratorio externo de los animales acuáticos, que permite tomar oxígeno disuelto del agua, y entregar dióxido de carbono.
Célula heterotópica: célula que crece en lugares anormales.
Cromosoma: corpúsculo de cromatina que interviene en la división celular. Está constituido por material genético (ADN) asociado a proteínas.
Ecotoxicología: rama de la toxicología que estudia las fuentes de productos tóxicos, su movilidad y persistencia en el ambiente y en las cadenas tróficas, sus mecanismos de transformación, y sus efectos sobre la dinámica de poblaciones de las especies afectadas.
Electrólisis: descomposición de una sustancia química por efecto del pasaje de una corriente eléctrica.
Etiología: en Medicina, la causa u origen de una enfermedad.
Estado de oxidación: carga eléctrica aparente que presenta un elemento químico en una especie química. En los iones, el estado de oxidación es simplemente la carga del ion. En otros compuestos, se calcula con reglas sencillas que atribuyen a los distintos átomos los electrones compartidos.
Eucariota (eucarionte): organismo constituido por células con núcleos verdaderos. Su ADN está contenido en el núcleo, que se separa del resto de la célula por una doble membrana. Los organismos eucariontes pueden ser unicelulares o pluricelulares.
Galvanoplastia: proceso electroquímico de depósito de una capa fina de metal sobre un material de base.
Gónada: órgano reproductor (ovario y testículos, en los seres humanos).
Hidrólisis: en el texto, es una reacción química por la cual un ion metálico hidratado libera protones al medio, generando un catión hidrolizado. Por ejemplo:
Fe(H2O)63+ ?Fe(OH)(H2O)52+ + H+
Mitocondria: orgánulos presentes en el citoplasma celular, cuya función principal es la oxidación de metabolitos y la fosforilación oxidativa que conduce a la síntesis de ATP (adenosintrifosfato).
Mutágeno: agente físico o químico capaz de inducir mutaciones en el ADN.
Neuropatía periférica: insuficiencia de los nervios que llevan la información hasta y desde el cerebro y la médula espinal, con dolor, pérdida de la sensibilidad y del control muscular.
Picolinato: sal del ácido picolínico (piridin2-carboxílico):

Potencial redox, potencial normal de reducción: el potencial redox o potencial de reducción es una medida de la tendencia que tiene una determinada especie química de ganar electrones, reduciéndose. Se mide en voltios, y cuanto más alto (más positivo) es, menor es la tendencia a reducirse. Los oxidantes fuertes, que se reducen fácilmente, tienen potenciales redox muy negativos. El potencial normal es el que se mide en condiciones estándar de concentraciones de las especies participantes.
Procariota (procarionte): organismo unicelular que no posee un núcleo claramente diferenciado. Su ADN se encuentra disperso en el citoplasma.
Soda cáustica: hidróxido de sodio, NaOH.
Verdín: para la Real Academia Española, el verdín, o cardenillo, es una mezcla de acetatos de cobre. Los químicos usan el término en un sentido más amplio, para denominar la pátina verdosa o verde azulada que se forma sobre superficies de cobre y que puede contener, además de los acetatos básicos, óxidos, hidróxidos o carbonatos básicos.
[1]La Prehistoria es el período del cual no hay registros escritos
[2] Es importante recordar que todo uso del lenguaje no es neutro. En particular, las connotaciones peyorativas de edad de piedra han llevado a la Asociación de Antropólogos Sociales (ASA) del Reino Unido a desaconsejar el uso del término. Ver: http://www.theasa.org/news.htm.
[3] Por convención, las semirreacciones se escriben como reducciones.
[4]J.B. Vincent y D. Stallings, Introduction. A history of chromium studies. En: The nutritional biochemistry of chromium(III), Capítulo 1, Elsevier, págs. 1-40 (2007).
[5] Q. Ke y M. Costa, Overwiev of chromium(III) toxicology. En: The nutritional biochemistry of chromium(III), Capítulo 12, Elsevier, págs. 257-263 (2007).
[6] Organización Mundial de la Salud, Chromium in drinking water, WHO/SDE/WSH/03.04/88. Ver: http://www...q/chemicals/chromium.pdf
[7] Expert Group on Vitamins and Minerals, Review Of Chromium, Evm/99/26 (2002). Ver: http://www.../pdfs/reviewofchrome.pdf.
[8]J.B. Vincent, The bioinorganic chemistry of chromium(III), Polyhedron 20, 1-26 (2001).
[9] International Agency for Research on Cancer. Chromium, nickel and welding. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 49). Lyon, 1990
[10]Environmental Protection Agency, Aquatic Life Ambient Freshwater Quality Criteria – Copper, Report EPA-822-R-07-001 (2007). Ver: http://www...nce/criteria/aqlife.html.
[11]G.K. Pagenkopf, Gill surface interaction model for trace-metal toxicity to fishes: Role of complexation, pH, and water hardness. Environ. Sci. Technol. 17:342-347 (1983).
[12] Organización Mundial de la Salud, Copper in drinking water, WHO/SDE/WSH/03.04/88. Ver: http://www...dwq/chemicals/copper.pdf
[13] H.B. Nicolli, M. del C. Blanco, J.D. Paolini y C.E. Fiorentino, Ambientes afectados por el arsénico. En: Iberoarsen: Distribución del arsénico en las regiones Ibérica e Iberoamericana. Capítulo 4, páginas 49-76. J. Bundschuh, A. Pérez Carrera y M.I. Litter (Editores). Ediciones CYTED, Buenos Aires, Argentina (2008). ISBN: 13 978-84-96023-61-1.
[14] J.L. Fernández-Turiel, G. Galindo, M.A. Parada, D. Gimeno, M. García-Vallès y J. Saavedra, Estado actual del conocimiento sobre el arsénico en el agua de la Argentina y Chile: origen, movilidad y tratamiento. En: Arsénico en el agua: origen, movilidad y tratamiento. G. Galindo, J.L. Fernández-Turiel, M.A. Parada, D. Gimeno Torrente (Editores). II Seminario Hispano-Latinoamericano sobre temas actuales de Hidrología Subterránea y IV Congreso Hidrogeológico Argentino, Río Cuarto, Córdoba (2005). Ver: http://www...lindo_et_al-Arsenico.pdf
[15] M. Goyenechea, Sobre la nueva enfermedad descubierta en Bell-Ville. Revista Médica de Rosario 7, 485 (1917).
[16] A. Ayerza, Boletín de la Academia Nacional de Medicina 1, 11 (1917).
[17]Organización Mundial de la Salud, Arsenic in drinking water, WHO/SDE/WSH/03.04/75. Ver: http://www...wq/chemicals/arsenic.pdf
[18] D.N. Guha Mazumder, Chronic arsenic toxicity & human health, Indian J. Med. Res. 128, 436-447 (2008).
[19]P.L. Smedley y D.G. Kinniburgh, A review of the source, behaviour and distribution of arsenic in natural waters. Applied Geochemistry 17 (2002) 517–568.
[20] IPCS (2001) Arsenic and arsenic compounds. Ginebra, World Health Organization, International Programme on Chemical Safety (Environmental Health Criteria 224).
[21] Traducción libre el texto de la referencia 15. v [22] J. Bundschuh, A. Pérez Carrera y M.I. Litter (Editores), Iberoarsen: Distribución del arsénico en las regiones Ibérica e Iberoamericana. Ediciones CYTED, Buenos Aires, Argentina (2008). ISBN: 13 978-84-96023-61-1.
[23] J. Bundschuh, H.B. Nicolli, M. Del C. Blanco, M. Blarasin, S.S. Farías, L. Cumbal, L. Cornejo, J. Acarapi, H. Lienqueo, M. Arenas, R. Guérèquiz, P. Bhattacharya, M.E. García, J. Quintanilla, E. Deschamps, Z. Viola, M.L. Castro de Esparza, J. Rodríguez, A. Pérez Carrera y A. Fernández Cirelli, Distribución de arsénico en la región sudamericana. En: En: Iberoarsen: Distribución del arsénico en las regiones Ibérica e Iberoamericana. Capítulo 7, páginas 137-185. J. Bundschuh, A. Pérez Carrera y M.I. Litter (Editores). Ediciones CYTED, Buenos Aires, Argentina (2008). ISBN: 13 978-84-96023-61-1.
[24] http://www...-129999/128630/norma.htm
[25] Para aguas minerales, el límite establecido por el CAA es de 0,2 mg/L, veinte veces más alto que para el agua distribuida por red.
[26] M.G. García, Tesis Doctoral, Universidad Nacional de Tucumán (2002).
[27] A.M. Sancha, Experiencia en remoción de arsénico mediante una tecnología simple y económica. Estudio de caso: Chile. V Congreso Iberoamericano de Física y Química Ambiental, Mar del Plata (2008).
[28] 1 bar = 1000 hPa (hectopascales) =1000 mbar, mientras que 1 atm = 1013,2 mbar. Como unidad de presión, el bar es pues levemente menor que la atmósfera.
[29] E. Dodero, A. Pirosky, J. Guberman, L. Martínez, y G. Tarquini. Tratamiento por ósmosis inversa de aguas con alto contenido de arsénico y flúor. Asociación Argentina de Ingeniería Sanitaria y Ciencias del Ambiente. Potabilización de aguas con arsénico y flúor. Tomo 2, págs. 144-149 (1996).
[30] S.I. Curto, N.A. Mendiburo, R. Plastina y R. Boffi, Arsénico en acuíferos: influencia sobre la salud de la población, http://www...rsenico_en_acuiferos.pdf [31] Ver por ejemplo la oferta de la empresa EWI: http://www.../productos-industria.htm
[32] Ver el Boletín del 23 de julio de 2010 de ABSA: http://www.aguasbonaerenses.com.ar
[33] A.M. Ingalinella, R.G. Fernández y L.M. Stecca, Proceso ARCIS-UNR para la remoción de arsénico y flúor en aguas subterráneas: Una experiencia de aplicación. http://www...bvsacd/aidis12/arcis.pdf
[34]Organización Mundial de la Salud, Cadmium in drinking water, WHO/SDE/WSH/03.04/80. Ver: http://www...wq/chemicals/cadmium.pdf
[35] S. Baggio, M.A. Blesa y H. Fernández, Química Inorgánica. Un Curso teórico-práctico. Capítulo 7. Tercera Edición, UNSAM Edita (2010, en prensa).
[36] Se ha estimado que se liberan 450 g de mercurio por cada tonelada de soda cáustica producida. Ver: IPCS (1991) Inorganic Mercury. Ginebra, World Health Organization, International Programme on Chemical Safety (Environmental Health Criteria 118).
[37] IPCS (2001) Methylmercury. Ginebra, World Health Organization, International Programme on Chemical Safety (Environmental Health Criteria 101).
[38] F. Bakir y otros, Methylmercury poisoning in Iraq, Science 181, 230-241 (1973).
[39]Ministry of Environment of Japan, Minamata Disease. History and Measures. http://www.../minamata2002/index.html
[40] Estudio de Jülich Forschungzentrum (Alemania) para la Secretaría de Recursos Naturales y Ambiente Humano (1999)
[41] National Status and Trends (NS&T) Program de la national Oceanic and Atmospheric Administration (NOAA) de EE.UU., Sediment Quality Guidelines developed for the National Status and Trend Program, http://response.restoration.noaa.gov/book_shelf/121_sedi_qual_guide.pdf
[42] La excepción la constituyen los infantes alimentados con biberones.
[43]WHO/SDE/WSH/03.04/09 Lead in drinking water. Ver: http://www...h/dwq/chemicals/lead.pdf v [44]http://www...I_Agua_actualiz-4-10.pdf

